Sự khác biệt giữa Sigma và Pi trái phiếu Sự khác biệt giữa
Trái phiếu Sigma là gì?
Các liên kết Sigma là liên kết giữa các nguyên tử trong các phân tử được hình thành dọc theo trục kết nối các hạt nhân bị ràng buộc của các nguyên tử.
Liên kết phân tử
Các phân tử hình thành khi các nguyên tử trao đổi hoặc chia sẻ điện tử thông qua liên kết hóa học. Về cơ bản có ba loại trái phiếu. Trái phiếu ion, trái phiếu kim loại, và trái phiếu cộng hóa trị. Trong các liên kết ion, các nguyên tử đơn giản sẽ trao đổi một electron để một nguyên tử sẽ tích điện dương và một điện tích âm khác, khiến chúng trở nên thu hút bởi lực điện từ. Trong các liên kết kim loại, các electron sẽ được phân bố đều xuyên qua toàn bộ phân tử tạo ra một biển các electron tự do, delecalized bao phủ các ion tích điện dương được thu hút bởi các điện tử.
Trong các liên kết đồng hóa trị, các electron được chia sẻ và cách chúng được chia sẻ thông qua các đám mây xác suất của các electron, và các orbitals mà chúng nằm, chồng chéo theo một cách gần như đối xứng.Orbitals và các liên kết sigma
Orbitals là các vùng xung quanh các nguyên tử gắn liền với mức năng lượng nhất định. Các electron trong các quỹ đạo xa hơn từ hạt nhân sẽ có năng lượng nhiều hơn các điện tử trong orbitals gần với hạt nhân hơn. Khi các orbitals của một nguyên tử chồng lên nhau với các orbit từ một nguyên tử khác, chúng hình thành các orbital phân tử cho phép các liên kết phân tử, dĩ nhiên, cho phép các phân tử.
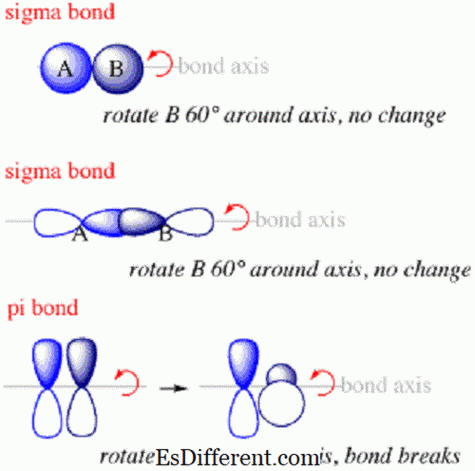
Các liên kết Sigma là loại liên kết đầu tiên sẽ hình thành giữa các nguyên tử. Trong một liên kết sigma, các đám mây xác suất electron sẽ dọc theo trục kết nối các hạt nhân của các nguyên tử ngoại quan. Sigma trái phiếu thường sẽ hình thành khi
sorbitals từ các nguyên tử khác nhau chồng lên nhau để tạo ra một liên kết. Chúng sẽ luôn luôn hình thành dọc theo trục giữa hai hạt nhân vì quỹ đạo được sắp xếp trong một cái gì đó giống như một quả cầu xung quanh hạt nhân. Các electron tạo thành liên kết sigma sẽ nằm trong quỹ đạo sigma và do đó sẽ ở đâu đó dọc theo trục kết nối hạt nhân của các nguyên tử ngoại quan. Tuy nhiên, liên kết sigma có thể ổn định hoặc không ổn định tùy thuộc vào việc các electron nằm trong quỹ đạo liên kết sigma hay quỹ đạo chống ăn mòn. Các quỹ đạo liên kết Sigma sẽ nằm trong không gian giữa các hạt nhân trong khi các quỹ đạo chống ăn mòn sẽ dọc theo trục kết nối các hạt nhân nhưng ở các cạnh của các nguyên tử đối diện với không gian giữa chúng. Liên kết sigma sẽ ổn định nếu các electron khác nằm trong các liên kết orbitals và không ổn định nếu có nhiều hơn trong orbitals kháng hoặc nếu có một số bằng nhau của các điện tử trong cả hai. Trái phiếu Pi là gì?
Trái phiếu Pi là liên kết giữa các nguyên tử trong các phân tử, nơi các electron nằm trên và dưới trục kết nối các hạt nhân của các nguyên tử đã ghép nhưng không dọc theo trục.Chúng là loại thứ hai của liên kết sẽ hình thành trong một phân tử sau khi liên kết sigma.Trái phiếu Pi và
p
orbitals
Lý do cho các liên kết pi ở trên và dưới trục liên kết nhưng không phải dọc theo nó là bởi vì chúng hình thành từ các quỹ đạo chồng chéo nhau như
p
orbitals trên các nguyên tử ngoại quan. Các orbitals không có mật độ electron ở hạt nhân. Kết quả là, các electron tạo nên các liên kết pi tạo thành từ các orbitals p chồng chéo nhau sẽ luôn luôn nhóm trong một vùng không trực tiếp với hạt nhân. Pi trái phiếu cũng có thể hình thành giữa orbitals nguyên tử khác, chẳng hạn như orbitals
d có các tính năng phổ biến với orbitals p. Trái phiếu pi và các quỹ đạo pi Khi các orbit của p các nguyên tử khác nhau trùng nhau, chúng tạo ra các vòng orbê phân tử phân tử cho phép hình thành các liên kết pi. Trái phiếu một lần nữa có thể ổn định hoặc không ổn định tùy thuộc vào quỹ đạo mà trong đó điện tử nằm. Các liên kết pi sẽ được ổn định nếu có nhiều electron nằm trong các liên kết pi orbitals. Nó sẽ không ổn định nếu có nhiều trong orbitals chống liên kết hoặc nếu một số bằng nhau là trong cả hai. Các điểm tương đồng giữa các liên kết sigma và liên kết pi Trái phiếu Sigma và liên kết pi đều dựa trên các orbital phân tử cụ thể xuất phát từ sự chồng chéo của các orbital nguyên tử cụ thể, ví dụ, orbitals
s
trong trường hợp của các liên kết sigma và các orbitals p trong trường hợp liên kết pi. Chúng cũng có thể ổn định hoặc không ổn định tùy thuộc vào việc các electron nằm trong các orbit liên kết hoặc liên kết các phân tử orbital.
Sự khác biệt giữa trái phiếu sigma và trái phiếu pi
Mặc dù có sự tương đồng, có những khác biệt quan trọng. Các electron tạo ra các liên kết sigma sẽ được phân bố trong không gian dọc theo trục kết nối các hạt nhân kết hợp trong khi các điện tử trong các liên kết pi sẽ được phân bố trên và dưới trục nhưng không theo nó. Các liên kết Sigma là các liên kết đầu tiên tạo thành giữa các nguyên tử trong các phân tử trong khi đó liên kết pi là thứ hai. Trái phiếu Sigma thường được hình thành bởi sự kết hợp của orbitals s
trong các nguyên tử khác nhau trong khi các liên kết pi được hình thành từ sự kết hợp của
p
- và các orbital tương tự ở các nguyên tử khác nhau.
- Ngoài ra, định hướng của các quỹ đạo chồng chéo tạo thành các liên kết pi sẽ vuông góc với các quỹ đạo chồng chéo tạo thành các liên kết sigma.
- Trái phiếu Sigma và liên kết pi Trái phiếu Sigma Trái phiếu Pi Các orbital nguyên tử chồng lên nhau theo trục liên kết Các orbital nguyên tử chồng lên trên và dưới trục liên kết Các liên kết đầu tiên tạo thành giữa các nguyên tử trong các phân tử
- Các liên kết thứ hai tạo thành giữa các nguyên tử trong các phân tử




