Sự khác biệt giữa việc chuẩn độ axit-base và khử oxi hóa redox | Dung dịch axit-bazơ so với dung dịch redox
các chuẩn độ được sử dụng để xác định nồng độ của một dung dịch không rõ (analyte). Các phương pháp chuẩn độ phổ biến nhất được sử dụng là chuẩn độ axit-bazơ và chuẩn độ oxi hóa khử. Sự khác biệt chính
giữa các chuẩn độ axit-bazơ và các chuẩn độ oxy hóa redox là bản chất của phản ứng xảy ra giữa hiệu chuẩn và chất phân tích 999 trong phép chuẩn độ. Trong quá trình chuẩn độ axit-bazơ, một phản ứng trung hoà xảy ra và trong các phản ứng oxi hóa khử, một phản ứng oxi hóa xảy ra (một phản ứng oxy hoá và một phản ứng giảm). Việc sử dụng các chỉ số là phương pháp được sử dụng phổ biến nhất để xác định điểm cuối của phản ứng. Titration Acid-Base là gì? Khi chuẩn độ axit-bazơ, một axít (dung môi axit) hoặc một bazơ (các chuẩn cơ bản) được sử dụng làm hiệu chuẩn. Các ví dụ về axit được sử dụng trong việc chuẩn độ axit là H
2SO
4 , HCl, hoặc HNO 3. Các mức chuẩn cơ bản được sử dụng chủ yếu là NaOH, K 2 CO 3 hoặc Na 2 CO 3. Sự chuẩn độ axit-bazơ có thể được phân loại như sau tùy thuộc vào độ mạnh của axit và bazơ. Các axit mạnh - các hợp chất cơ bản mạnh Các axit mạnh - các điều kiện cơ bản yếu Axit yếu - các phương pháp chuẩn cơ bản
Axit yếu - các điều kiện cơ bản yếu- Trong phần lớn axit -biến áp, các chỉ số được sử dụng để xác định điểm kết thúc của phản ứng. Các chỉ số khác nhau được sử dụng tùy thuộc vào loại phép chuẩn độ như đã đề cập ở trên.
- Định lượng Redox là gì?
- Phản ứng oxi hóa khử oxy hóa liên quan đến phản ứng redox. Phản ứng Redox có hai phản ứng; một phản ứng oxy hóa và một phản ứng giảm. Cả hai quá trình oxy hóa và giảm được diễn ra đồng thời cho phép chúng ta xác định hoàn thành phản ứng. Đây cũng được gọi là điểm kết thúc của phép chuẩn độ. Điều này có thể được xác định bằng nhiều cách; sử dụng các chỉ báo điện cực, các chỉ số redox (chỉ thị cho một màu khác ở trạng thái giảm oxy hoá), và các chỉ số không phải là redox (chỉ báo tạo ra màu sắc khi bổ sung thêm một lượng gia vị bổ sung).
Sự chênh lệch giữa Tiêu chuẩn Acid-Base và Tốc độ Đỏ là gì?
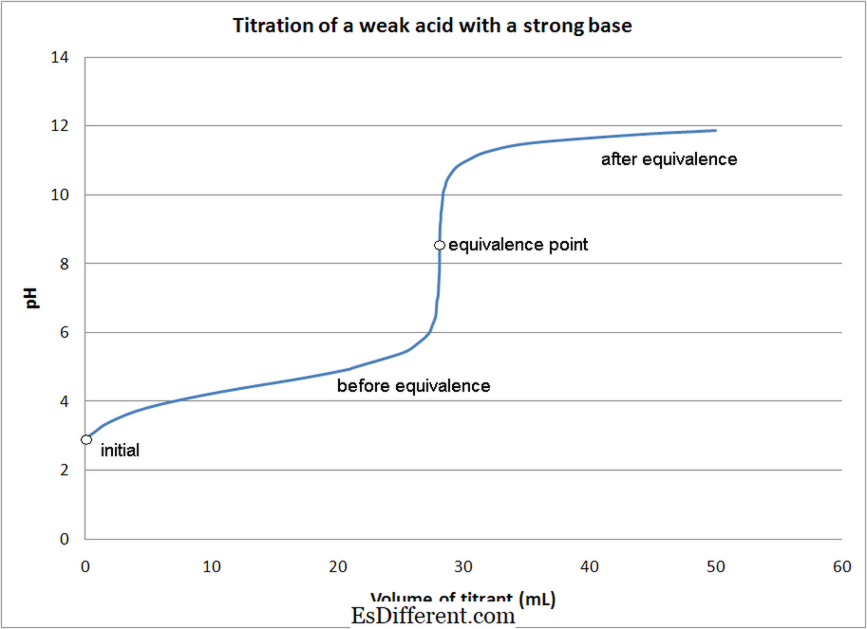
Chuẩn độ axit-baz:
Việc chuẩn độ axit-bazơ liên quan đến phản ứng trung hòa giữa chất phân tích (dung dịch có nồng độ không biết) và chất chuẩn axit hoặc cơ bản.

Phản ứng Redox:
Phản ứng oxi hóa khử có liên quan đến phản ứng oxy hoá và giảm giữa chất phân tích và thuốc thử. Không có một nguyên tắc nào mà thành phần bị oxy hóa và cái nào làm giảm. Cả chất phân tích hoặc thuốc thử sẽ bị oxy hoá, và thành phần còn lại sẽ làm giảm.
Xác định điểm cuối: Tiêu chuẩn axit-bazơ:
Nói chung, một chỉ thị pH, một máy đo pH hoặc một máy đo độ dẫn được sử dụng để xác định điểm kết thúc của một phép chuẩn độ axit-bazơ. Phản ứng khử Redox:
Phương pháp được sử dụng phổ biến nhất để xác định điểm kết thúc của phản ứng redox đang sử dụng một Potentiometer hoặc một chỉ thị redox. Tuy nhiên, thường xuyên nhất, hoặc là chất phân tích hoặc thuốc thử sẽ tạo ra màu sắc ở điểm cuối. Do đó, các chỉ số bổ sung là không bắt buộc trong những trường hợp đó.
Ví dụ: Chuẩn độ axit-baz:
- Loại
Phản ứng (Chỉ số)
Axit mạnh - Chuẩn độ cơ bản mạnh
HCl + NaOHaNaCl + H| 2 | O (Phenolphthalein / Methyl màu cam) |
| Axit mạnh - Tiêu chuẩn cơ bản yếu | HCl + NH 3 NH |
| 3 | Cl (Methyl cam) Axit yếu - độ chuẩn cơ mạnh CH 3 COOH + NaOHα CH |
| 3 | COONa + H 2 O (Phenolphthalein) Axit Yếu - Chuẩn Đoan cơ Nặng CH 3 COOH + NH |
| 3 | à> 3 COO - + NH 4 + (Không có chỉ thị thích hợp) Phản ứng khử đỏ: 2 KMnO 4 + 5 H |
2
C 2 O 4 + 6 HCl → 2 MnCl 2 + 2 KCl + 10 CO 2 + 8 H 2 O (+ 7) (+3) (+2) (+ 4) Trong phản ứng trên, permanganat giảm trong khi oxalic acid bị oxy hóa. Khi phản ứng hoàn thành, màu tím của permanganat chuyển thành màu không màu. KMnO 4 + 5FeCl 2
+ 8HCl
→
5FeCl 3 + MnCl 2 + KCl + 4H 2 O (+ 7) (+2) (+3) (+2) Hình ảnh lịch sự: 1. Phản ứng axit yếu với bazơ mạnh Theo Quantumkinetics (Tác phẩm của chính mình) [CC BY 3. 0], Wikisource 2. "Chuẩn độ chuẩn của Winkler Titration" của Willwood [CC BY-SA 3. 0] qua Commons




