Sự khác biệt giữa sự cân bằng và electron trị giá | Điện trở so với điện tích Valence
Những sự khác biệt chính - Sự tương xứng và sự cân bằng điện tử
Các điện tử và electron trị giá trị valentine là những thuật ngữ liên quan đến nhau, và sự khác biệt chính giữa valent và valence electron được giải thích rõ nhất trong các định nghĩa của chúng; điện tử hóa trị là các điện tử trong vỏ ngoài cùng của một phần tử trong khi điện tử hóa trị là số điện tử cần được chấp nhận hoặc gỡ bỏ để đạt được cấu hình khí quyển gần nhất. Đó là các điện tử trong lớp ngoài cùng mà thường đóng góp vào hình thành các liên kết hóa học. Trong một số nguyên tử, số lượng các điện tử hóa trị bằng với số lượng electron cân bằng.
Điện tử VVĩ tinh là gì? Số lượng electron trong vỏ ngoài cùng của một nguyên tử được gọi là "các điện tử hoá trị. Vì lý do này, vỏ ngoài cùng của một nguyên tử được gọi là "vỏ giá trị". Hầu hết thời gian, đây là những điện tử, tham gia vào liên kết hóa học. Khi các nguyên tố tạo thành cation, chúng sẽ loại bỏ các electron khỏi vỏ giá trị. Số lượng các điện tử hóa trị trong một phần tử xác định nhóm trong bảng tuần hoàn.

Số electron cần thiết để đạt được hoặc mất để lấp đầy vỏ ngoài cùng của một nguyên tử được gọi là "điện tử có giá trị". Đối với một nguyên tử đặc biệt, số lượng các electron cân bằng phụ thuộc vào số lượng điện tử hóa trị trong nguyên tử. Đối với Natri, giá trị bằng 1, bởi vì nó loại bỏ các electron cuối cùng trong vỏ ngoài cùng để đạt được cấu trúc octet của khí cụ quý hiếm gần nhất.
|
Định nghĩa của điện tử Valent và Valence Các electron:
Các electron điện tử:
Các điện tử trong vỏ ngoài cùng của một nguyên tử được gọi là "các điện tử hóa trị". Đối với các phần tử nhóm "s" và "p", số lượng điện tử hóa trị bằng với số nhóm của chúng. Ví dụ
Các electron điện tử:
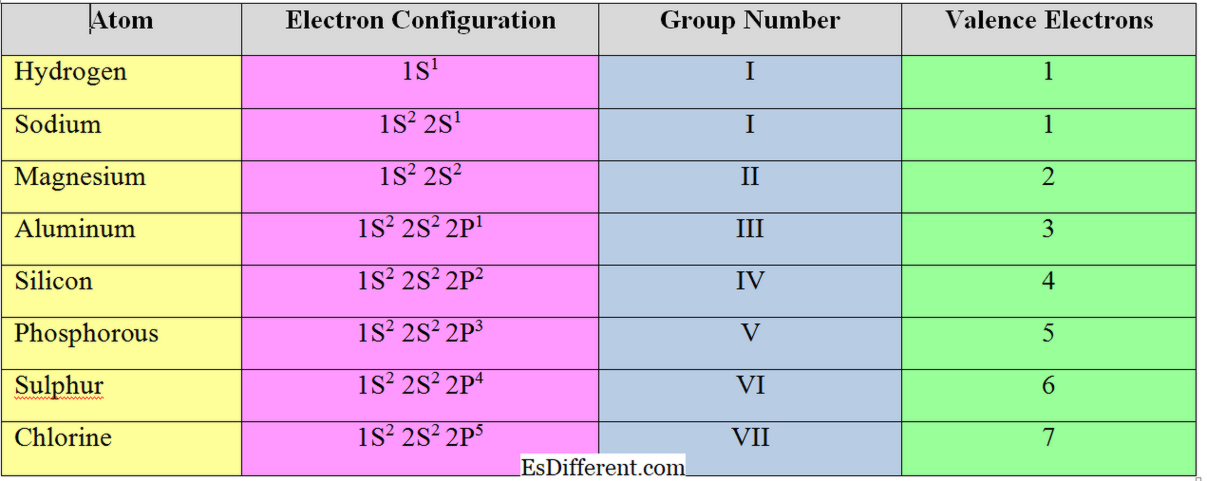
Số electron cần được chấp nhận hoặc loại bỏ để đạt được cấu hình điện tử của khí cụ quý hiếm gần nhất được gọi là "valent electrons" hoặc "valence" của một nguyên tử. Nói chung, đối với các nguyên tố kim loại (các yếu tố trong nhóm I, II và III), số lượng các điện tử hóa trị bằng với số lượng các electron điện dung; họ loại bỏ các điện tử trong vỏ giá trị để đạt được cấu trúc octet.
Tuy nhiên, các phần tử không kim loại chấp nhận điện tử để đạt được cấu hình điện tử của khí cụ quý hiếm gần nhất. Vì vậy, tính hợp lý của các nguyên tố phi kim loại được tính bằng cách trừ các electron hóa trị từ 8.
Đối với clo, Số điện tử valent = 8-7 = 1
Các đặc tính của điện tử Valency và Valence

Valency and Valence Electrons Electrons Valence của các nguyên tố nhóm VIII
Các electron điện tử:
Các nguyên tố nhóm VIII là các khí độc cao, và chúng có tính ổn định hóa học. Vỏ bên ngoài của chúng đã hoàn thành, và nó chứa tám điện tử trong vỏ ngoài cùng (ngoại trừ Helium-He); do đó các electron nhóm VIII có tám electron hóa trị. Các electron điện tử:
Độ dài là sự đo lường về khả năng tạo thành các liên kết với các nguyên tố hoặc phân tử khác. Khí Noble không chấp nhận hoặc loại bỏ các electron để đạt được quy tắc octet vì chúng đã hoàn thành vỏ cuối cùng. Do đó, tính hợp lý của các yếu tố nhóm VII bằng không. Hình ảnh được phép bởi:
"Electron shell 010 Neon - không có nhãn" của commons: Người dùng: Pumbaa (tác phẩm gốc bởi commons: User: Greg Robson) - // commons. wikimedia. org / wiki / Category: Electron_shell_diagrams (phiên bản gắn nhãn tương ứng). (CC BY-SA 2. 0 uk) thông qua Commons




