Sự khác biệt giữa Octet và Duplet | Octet vs Duplet
Sự khác biệt chính - Octet vs Duplet
Có các nguyên tử hoặc các hợp chất hoạt động hóa học có trong tự nhiên. Đặc tính này chủ yếu phụ thuộc vào số lượng các electron có trong vỏ ngoài cùng của các nguyên tử. Các nguyên tử có vỏ không hoàn chỉnh có thể trở nên hoạt động để hoàn thành cấu hình điện tử của chúng để trở nên ổn định. Các nguyên tử không hoạt động có cấu hình electron hoàn chỉnh; do đó các nguyên tử này không phản ứng với bất kỳ nguyên tử nào khác trừ khi có điều kiện đặc biệt. Khí Noble luôn luôn không hoạt động trong tự nhiên. Do đó, chúng được gọi là khí trơ. Các khí trơ nằm trong cột thứ tám trong bảng tuần hoàn. Các yếu tố khác trong cùng khoảng thời gian (hàng) có khuynh hướng có được cấu hình điện tử của khí trơ vào cuối giai đoạn đó, hình thức ổn định nhất trong tự nhiên. Các nguyên tử hoạt động có khuynh hướng hoàn thành số lượng các electron theo quy tắc octet hoặc quy tắc duplet . Sự khác biệt chính giữa octet và duplet là octet là một nguyên tử hoặc một ion có tối đa tám electron trong lớp ngoài cùng trong khi duplet là một nguyên tử có tối đa hai điện tử trong vỏ ngoài cùng.
NỘI DUNG
1. Tổng quan và Chênh lệch khác nhau
2. Octet là gì
3. Tờ Duplet là gì
4. So sánh từng bên - Octet vs Duplet
5. Tóm tắt
Octet là gì?
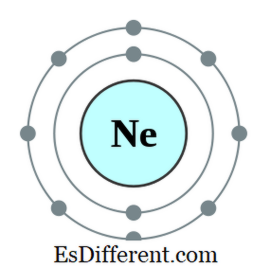
Một octet là một nguyên tử hoặc một ion có tám electron trong vỏ ngoài cùng của nguyên tử đó. Tất cả các khí độc cao trừ helium có tám electron và trong tự nhiên. Cấu hình điện tử của một khí độc sẽ luôn luôn kết thúc như sau.
2- ns2 np 6 Ví dụ, cấu hình điện tử của Neon là 1s
2 2s 2 2p 6 . Neon là một khí trơ. Các nguyên tố khác có bảy, sáu, vv điện tử trong quỹ đạo ngoài cùng có xu hướng tuân theo quy tắc octet bằng cách lấy điện tử từ bên ngoài; một số yếu tố khác có một, hai, vv điện tử có xu hướng mất điện tử và có được cấu hình điện tử của khí trơ gần nhất. Nhưng các yếu tố khác ở giữa bảng tuần hoàn sẽ hình thành các liên kết mới với các nguyên tố có lượng electron dư thừa để chia sẻ các electron đó và trở thành một octet.
Duplet là gì?
Nguyên tử hiđrô và nguyên tử hêli là các nguyên tố nhỏ nhất trong tự nhiên và chỉ có một quỹ đạo xung quanh hạt nhân của chúng. Vòng quỹ đạo này được gọi là quỹ đạo 1s. Vòng này có thể chứa tối đa hai điện tử. Nguyên tử hydro có một electron và helium có hai điện tử. Do đó, helium được gọi là duplet.Helium có số electron tối đa mà nó có thể có; do đó nó là một yếu tố ổn định trong tự nhiên. Do đó, Helium cũng là một khí trơ. Nhưng hydro chỉ có một electron và quỹ đạo duy nhất nó đã không đầy đủ. Do đó, nguyên tử hydro chỉ phản ứng rất mạnh và nó có xu hướng hình thành một liên kết cộng hoá trị với một nguyên tử hydro khác bằng cách chia sẻ các điện tử duy nhất mà chúng có. Sau đó, các nguyên tử hydro này trở thành các bản sao khi chúng có hai điện tử nằm trong quỹ đạo ngoài cùng của chúng. Nhưng Lithium cũng có thể hoạt động như một bản sao bằng cách loại bỏ các electron từ quỹ đạo ngoài cùng của nó. Cấu hình electron của Lithium là 1s
2 2s 1 . Bằng cách loại bỏ electron 2s 1 , nó có thể trở thành một bản sao. Trong trường hợp đó, ông, H - và Li + là những bản sao có thể tồn tại dưới dạng bản sao ổn định. Tất cả các duplets có cấu hình electron kết thúc như sau.
ns
2 Hình 02: Helium, một bản sao

sự khác biệt giữa Octet và Duplet là gì?
- diff Điều Trung trước Bảng ->
Octet vs Duplet
Octet có tám electron trong vỏ ngoài cùng. |
|
| Duplet có hai điện tử trong vỏ ngoài cùng. | Cấu hình điện tử thông dụng |
| Octet có ns | |
| 2 np 6 kiểu cấu hình điện tử ở cuối. Duplet có ns | 2 kiểu cấu hình ở cuối. Số Orbitals |
| Octet có thể có tối thiểu hai orbitals. | |
| Một bản sao chỉ có một quỹ đạo. | Loại orbitals |
| Một octet có thể có tất cả các loại orbitals như s, p, d, f, vv | |
| Duplet chỉ có quỹ đạo. | Tóm tắt - Octet vs Duplet |
Tất cả các yếu tố có khuynh hướng ổn định. Nhưng với cấu hình electron không đầy đủ, nguyên tử không thể ổn định; do đó, chúng trở nên rất phản động để lấp đầy vỏ bằng điện tử bằng cách thu được, mất hoặc chia sẻ các điện tử. Các nguyên tử hoặc phân tử tuân theo quy tắc octet hoặc duplet là ổn định. Sự khác biệt chính giữa octet và duplet là octet có tám electron ở quỹ đạo ngoài cùng của nó trong khi duplet có hai electron nằm trong quỹ đạo của nó.
Tài liệu tham khảo:
1. Nema, P., 2011. Phổ biến nhất. [Trực tuyến] Có tại: // www. topperlearning. com / / home-work-help-19 / what-is-octet-duplet-valency-and-ion-hóa học-cấu trúc của nguyên tử-46317 / trả lời [Truy cập 29 05 2017].
2. Chang, R., 2010. Hóa học. 10th ed. New York: McGraw-Hill.
3. Anon., Năm 2015. Máy xếp hạng. [Trực tuyến] Có tại: // gradestack. com / NTSE-Hoàn tất khóa học / Hóa chất kết dính / Hoá chất-Hoạt động-An / 19176-3853-37737-study-wtw [Truy cập 29 05 2017].
Hình ảnh Courtesy:
1. "Electron shell 002 Helium - không có nhãn" By Pumbaa (tác phẩm gốc của Greg Robson) - Các sơ đồ vỏ electron (phiên bản gắn nhãn tương ứng) (CC BY-SA 2. 0 uk) thông qua Commons Wikimedia
2. "Electron shell 010 Neon" By Pumbaa (tác phẩm gốc của Greg Robson) (CC BY-SA 2. 0 uk) thông qua Commons Wikimedia


