Sự khác biệt giữa Monatomic và Diatomic | Monatomic vs Diatomic
Sự khác biệt giữa đơn nguyên và địa tầng chủ yếu liên quan đến các nguyên tử có trong loài. Như những cái tên gợi ý, cả hai thuật ngữ này đều có các trạng thái khác nhau của các hiệp hội nguyên tử, trong đó 'mono' có nghĩa là 'một' và 'di' có nghĩa là 'hai. 'Do đó, đơn giản, đơn nguyên là một'
một nguyên tử 'và các phương tiện' diatomic ' hai nguyên tử. ' Tuy nhiên, có thể có rất nhiều biến thể khác nhau cho định nghĩa cơ bản này.
Monatomic là gì?Khi
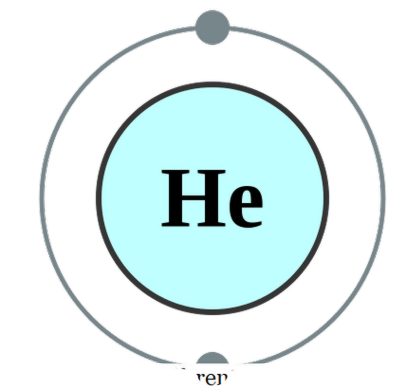
một nguyên tử tồn tại trên (mà hiếm khi xảy ra), chúng ta gọi nó là đơn nguyên. Điều này có nghĩa là các phần tử có dạng đơn nhất thuần túy. Ví dụ thực tế duy nhất thuộc thể loại này có thể là các khí độc mà tồn tại dưới dạng nguyên tử vì chúng có vỏ ngoài của chúng được hoàn thành với một octet điện tử. Do đó, chúng không nhìn nhận hay tặng thêm bất kỳ điện tử nào để ổn định hơn. Do đó, các khí độc cao thường ổn định ở dạng đơn nguyên. Một số ví dụ là; Anh - Helium, Ne - Neon, Ar - Argon, Xe - Xenon, Kr - Krypton, Rn - Radon.
Thế nào là tảo?
Khi
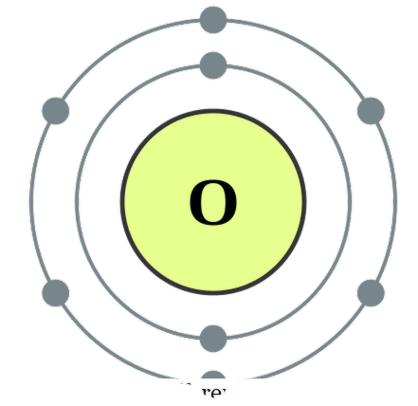
hai nguyên tử kết hợp với nhau , ta gọi nó là diatomic. Các nguyên tử này có thể cùng loại hoặc khác nhau. Khi chúng là hai nguyên tử tương tự trong mối liên hệ, chúng ta gọi nó là ~ và nếu chúng được tạo thành từ nhiều loại khác nhau, chúng ta gọi nó là các ~ ~ tảo cát heteronuclear . Ví dụ về một số tảo cát hạt nhân sẽ là O2, N2, H2, vv trong khi CO, NO, HCl, vv có thể được đưa ra làm ví dụ cho tảo cát hạt nhân. Ôxy Các tảo cát có thể được coi là các hợp chất khi chúng tạo thành các liên kết này để đạt được sự ổn định hơn bằng cách chia sẻ các electron với nhau để cho cả hai nguyên tử đạt được cấu hình điện tử cao quý. Chúng có thể liên kết qua các liên kết cộng hoá trị bởi sự chồng chéo của các orbital nguyên tử hoặc nếu không nó có thể hình thành các liên kết ion trong đó chúng là lực hút giữa một loài tích điện dương và các loài tích điện âm. Các ví dụ về liên kết hóa trị giữa tảo cát bao gồm CO, NO, vv và HCl có thể được xem như là một loài có đặc tính thu hút ion. Tuy nhiên, vì lực thu hút giữa H + và Cl- không phải là rất mạnh, nhưng nó không phải là một ví dụ rất tốt cho các liên kết ion là một chủ đề xác định khác. Sự khác biệt giữa Monatomic và Diatomic là gì? • Các loài đơn nguyên có một nguyên tử, trong khi các loài điatomic có hai nguyên tử.
• Các loài Monatomic nói chung không ổn định, nhưng các loài động vật điatomic thường ổn định.
• Khí Noble chỉ có đơn nguyên và không tìm thấy ở dạng diatomic.
• Mối liên kết hóa học tồn tại giữa các loài điatomic, trong khi không có mối liên hệ nào giữa các loài đơn nguyên.
Hình ảnh:
Cấu hình electron helium bởi Pumbaa (CC BY-SA 2. 0 uk)
Cấu hình electron oxy của DePiep (CC BY-SA 3. 0)




