Sự khác biệt giữa Methane và Ethane | Methane vs Ethane
Sự khác biệt chính - so với Ethane
Metan và Ethane là những thành viên nhỏ nhất trong họ Alkan. Các công thức phân tử của hai hợp chất hữu cơ này là CH 4 và C 2 H 6 tương ứng. Sự khác biệt quan trọng giữa Methane và Ethane là cấu trúc hóa học của chúng ; một phân tử Ethane có thể được coi là hai nhóm metyl kết hợp với nhau như một dimer của các nhóm methyl. Sự khác biệt hóa học và vật lý khác chủ yếu phát sinh do sự khác biệt cấu trúc này. Methane là gì? Metan là thành viên nhỏ nhất của họ alken với công thức hoá học CH
4(bốn nguyên tử hydro được liên kết với một nguyên tử cacbon). Nó được coi là thành phần chính của khí tự nhiên. Methane là một loại khí không màu, không mùi và không vị; còn được gọi là carbane
, khí đầm lầy, khí tự nhiên, carbon tetrahydrit, và hydro cacbua . Nó có thể dễ dàng đốt cháy, và hơi của nó nhẹ hơn không khí.
Ethane là gì? Ethane là một hỗn hợp khí không màu, không mùi ở nhiệt độ và áp suất tiêu chuẩn. Công thức phân tử và trọng lượng phân tử của nó là C 2 H 6
và 30. 07 g · mol
-1 tương ứng. Nó được phân lập từ khí tự nhiên, như là một sản phẩm phụ từ quá trình tinh chế dầu. Ethane rất quan trọng trong sản xuất ethylene.

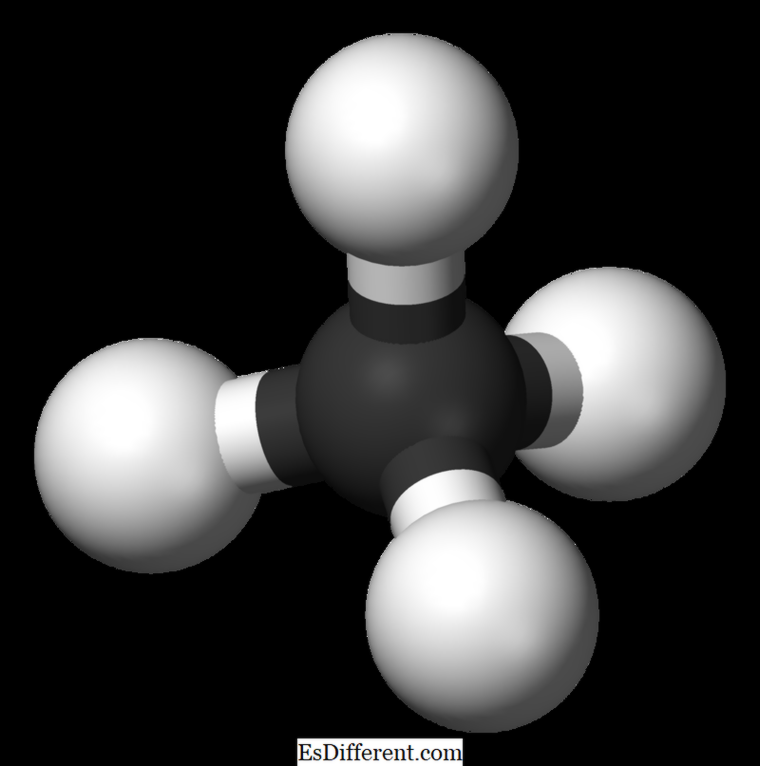
của mêtan
CH
4,
và nó là một ví dụ của một phân tử tứ diện với bốn liên kết CH tương đương (liên kết sigma). Góc trái giữa các nguyên tử H-C-H là 109. 5 0 và tất cả các liên kết C-H tương đương, và bằng với 108. 70 chiều. Ethan: Công thức phân tử của ethane C 2

H 6, và nó là một hydrocarbon bão hòa vì nó không chứa nhiều liên kết. Tính chất hóa học: Methan: Độ ổn định: Methane là một phân tử rất ổn định về mặt hoá học không phản ứng với KMnO 4 K

2
Cr < 2
O 7 , H 2 SO 4 hoặc HNO 3 trong điều kiện bình thường. Quá trình đốt cháy: Khi có khí hoặc oxy quá mức, khí mê-tan đốt cháy với một ngọn lửa không sáng màu xanh nhạt tạo ra carbon dioxide và nước.Đó là một phản ứng nhiệt độ cao; do đó, nó được sử dụng như một nhiên liệu tuyệt vời. Khi có không khí hoặc oxy không đầy đủ, nó sẽ cháy một phần thành khí carbon monoxide (CO). Các phản ứng thay thế: Metan cho thấy các phản ứng thay thế với halogen. Trong các phản ứng này, một hoặc nhiều nguyên tử hydro được thay bằng một số nguyên tử halogen bằng nhau và nó được gọi là "halogenation. "Nó phản ứng với chlorine (Cl) và brôm (Br) trong ánh sáng mặt trời. Phản ứng với hơi nước: Khi một hỗn hợp khí mê-tan và hơi được truyền qua một niken nung nóng (1000 K) được hỗ trợ trên bề mặt nhôm, nó có thể tạo ra hydro. Nhiệt độ:
Khi khí mê-tan được nung nóng đến khoảng 1300 K, nó sẽ bị phân hủy thành cacbon đen và hiđrô. Ethane:
Phản ứng: Khí ethane (CH
3 CH
3 ) phản ứng với hơi bromin khi có ánh sáng tạo thành bromoethane (CH 3
CH
2 Br) và hydrogen bromide (HBr). Đó là phản ứng thay thế; một nguyên tử hydro trong ethane được thay thế bằng nguyên tử brom. CH 3 CH 3 + Br 2 CH 3
CH 2 Br + HBr Sự đốt cháy: Sự đốt cháy hoàn toàn của ethane tạo ra 1559. 7 kJ / mol (51. 9 kJ / g) nhiệt, carbon dioxide, và nước. 2 C 2 H 6 + 7 O 2
→ 4 CO
2 + 6 H 2 O + 3120 kJ Nó cũng có thể xảy ra nếu không có quá nhiều oxy, tạo ra một hỗn hợp carbon vô định hình và carbon monoxide. 2 C 2 H 6 + 3 O 2 → 4 C + 6 H
2
O 2 2 H 6 + 5 O 2 → 4 CO + 6 H 2 O
năng lượng 2 C 2 H 6 + 4 O 2 → 2 C + 2 CO + H 2 O
+ năng lượng vv Định nghĩa: Phản ứng thay thế: Phản ứng thay thế là một phản ứng hóa học liên quan đến sự dịch chuyển của một nhóm chức trong một hợp chất hóa học và thay thế nó bởi một nhóm chức năng khác. Sử dụng: Metan: Metan được sử dụng trong nhiều quy trình hóa học công nghiệp (như nhiên liệu, khí thiên nhiên, khí tự nhiên hoá lỏng) và vận chuyển như chất làm lạnh. Ethane: Ethane được sử dụng làm nhiên liệu cho động cơ và làm chất làm lạnh cho một hệ thống cực kỳ thấp. Nó được vận chuyển trong các xi lanh thép như một loại khí hoá lỏng dưới áp suất hơi của nó. Tài liệu tham khảo: "Ethane". Wikipedia
. N. p., Năm 2016. Web. 7 tháng 6 năm 2016. Khanna, Bhishm. "Các tính chất hóa học của Methane là gì? ".
Kho bảo quản. com. N. p., Năm 2016. Web. 7 tháng 6 năm 2016. "Methane | CH4 - Pubchem ". Pubchem. ncbi. nlm. nih. gov
. N. p., Năm 2016. Web. Ngày 7 tháng 6 năm 2016. "Methane".
Wikipedia . N. p., Năm 2016. Web. Ngày 7 tháng 6 năm 2016. Hình ảnh: "Mẫu phân tử khí mê-tan" của (tên miền công cộng) thông qua Commons Wikimedia "mô hình quả cầu và phân tử ethane" y Ben Mills - Tác phẩm của chính mình (Public Domain) qua Commons Wikimedia "Methane" của Jynto - Tác phẩm của riêng, dựa trên File: Methane-CRC-MW-dimensions-2D.png, (Public Domain) qua Commons Wikimedia "Ethane" (Tên miền công cộng) thông qua Commons Wikimedia



