Sự khác biệt giữa S và P Các yếu tố Khối | S vs P Các yếu tố Khối
Sự khác biệt chính - S so với các phần tử khối P
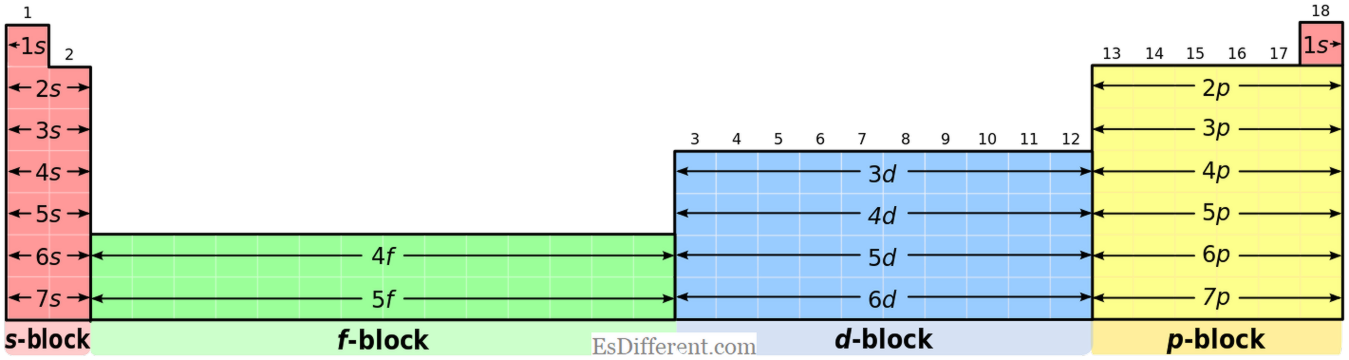
Sự khác nhau chính giữa các phần tử khối s và p có thể được giải thích tốt nhất bằng cách sử dụng cấu hình điện tử của chúng. Trong các phần tử ngăn chặn của s, electron cuối cùng đổ vào lớp vỏ bên dưới và trong phần tử ngăn chặn p, electron cuối cùng tràn vào lớp con. Khi chúng hình thành ion; các phần tử khối của chúng loại bỏ các electron của chúng từ lớp vỏ bên ngoài ra ngoài dễ dàng trong khi các phần tử khối p chấp nhận điện tử tới lớp vỏ con hoặc loại bỏ các electron khỏi lớp vỏ con. Một số phần tử trong nhóm p tạo thành các ion dương loại bỏ các electron khỏi subshell ngoài cùng bên ngoài và một số phần tử (phần tử điện tử nhất) tạo thành các ion âm chấp nhận một điện tử từ các nguyên tử khác. Khi bạn xem xét các tính chất hóa học, có một sự khác biệt đáng kể giữa các phần tử khối s và p; điều này cơ bản là do cấu hình điện tử.
S-block Elements là gì?
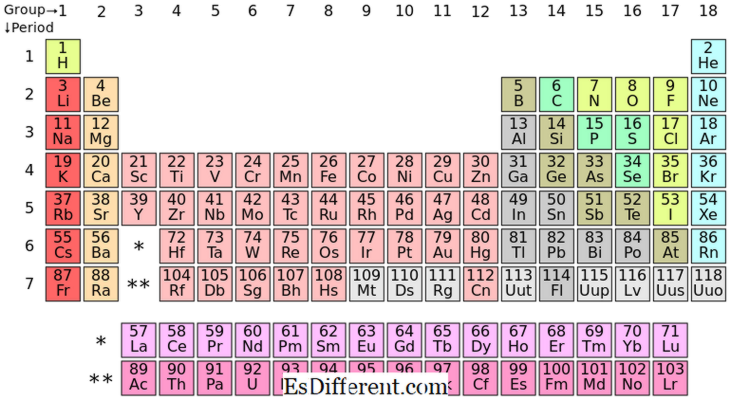
Các yếu tố khối S là các yếu tố hoá học trong nhóm I và nhóm II trong bảng tuần hoàn. Vì lớp vỏ ngoài của subshell chỉ có thể chứa được hai điện tử nên các nguyên tố này thường có một (nhóm I) hoặc hai electron (nhóm II) trong vỏ ngoài cùng. Các yếu tố trong nhóm I và II được trình bày ở trên.
- khác| 3 | ||
| Na | Mg | 4 |
| K | Ca | 5 |
| Rb | Sr | 6 |
| Cs 999 Ba 7 Các kim loại kiềm | II A | Các kim loại đất kiềm |
| Tất cả các nguyên tố trong s khối tạo thành các ion dương và chúng phản ứng rất mạnh. | Vị trí của S-block Elements trong bảng tuần | |
| Các phần tử khối p là các phần tử có electron cuối cùng đổ vào subshell p. Có ba quỹ đạo p; mỗi quỹ đạo có thể chứa hai điện tử, làm tổng cộng sáu electron p. Vì vậy, các phần tử khối p có từ một đến sáu electron p trong vỏ ngoài cùng của chúng. Khối P chứa cả kim loại và phi kim loại; ngoài ra có một số kim loại quá. | 13 |
| 14 | 15 |
16
17
182
B
| C | N | O | F Ne | 3 | Al | |
| Si | P | S | Cl Ar | 4 | Ga | Ge |
| Như | Kr | 5 | Trong | Sn | ||
| Sb | Te | I | Xe | 6 | Tl | Pb Bi |
| Po | Tại | Rn | Sự khác biệt giữa các yếu tố chặn S và P là gì? | Cấu hình điện tử thông dụng: | S-block Elements: | Các thành phần khối S có cấu hình điện tử phổ biến của [khí quý] ns |
| 1 | (đối với nhóm I) và [khí noble] ns | 2 | (đối với các yếu tố nhóm II). | Các nguyên tố P-block: | Các phần tử khối P có cấu hình electron chung của [khí quyển] ns | 2 |
np
1-6
. Nhưng, heli có cấu hình 1 giây 2 ; đó là một tình huống đặc biệt. Các quốc gia oxy hóa: S-block Elements: Các phần tử khối S không hiển thị trạng thái oxy hóa nhiều như các phần tử khối p. Ví dụ, các phần tử nhóm I hiển thị trạng thái ôxi hóa +1 và các phần tử nhóm II cho thấy trạng thái oxy hóa +2.
Các nguyên tố khối p: Không giống như các phần tử khối s, các phần tử p-block có trạng thái oxy hóa thông thường cho nhóm tương ứng của chúng trong bảng tuần hoàn và một số trạng thái oxi hóa khác phụ thuộc vào sự ổn định của ion. Nhóm 13 14 15 16 17
18
Cấu hình điện tử chung ns
2 np




