Sự khác biệt giữa 1s và 2s Orbital | 1s vs 2s Orbital
Sự khác biệt chính - 1s vs 2s Orbital
Atom là đơn vị nhỏ nhất của vật chất. Nói cách khác, tất cả vật chất được tạo ra từ các nguyên tử. Một nguyên tử bao gồm các hạt hạ nguyên tử, chủ yếu là proton, electron, và neutron. Protons và electron tạo ra hạt nhân, nằm ở trung tâm của nguyên tử. Nhưng các điện tử được định vị trong quỹ đạo (hoặc mức năng lượng) nằm ngoài hạt nhân của một nguyên tử. Cũng cần lưu ý rằng các orbitals là các khái niệm giả thuyết được sử dụng để giải thích vị trí có thể xảy ra nhất của nguyên tử. Có nhiều orbitals xung quanh hạt nhân. Ngoài ra còn có các quỹ đạo phụ chẳng hạn như s, p, d, f, vv Vùng dưới quỹ đạo có hình dạng hình cầu khi được coi là một cấu trúc 3D. Các quỹ đạo s có xác suất cao nhất của việc tìm kiếm một điện tử xung quanh hạt nhân. Một quỹ đạo nhỏ lại được đánh số lần lượt là 1s, 2s, 3s, … theo mức năng lượng. Sự khác biệt chính giữa quỹ đạo 1s và 2s là năng lượng của mỗi quỹ đạo. quỹ đạo 1s có năng lượng thấp hơn quỹ đạo 2 giây.
NỘI DUNG
1. Tổng quan và Chênh lệch khác nhau
2. 1s Orbital là gì
3. Orbital 2s là gì? 4. So sánh Side by Side - 1s vs 2s Orbital
5. Tóm tắt
1s Orbital là gì?
quỹ đạo 1s là quỹ đạo gần nhất với hạt nhân. Nó có năng lượng thấp nhất trong các orbitals khác. Nó cũng là hình cầu nhỏ nhất. Do đó, bán kính của quỹ đạo của quỹ đạo nhỏ. Chỉ có 2 electron trong quỹ đạo của quỹ đạo. Cấu hình điện tử có thể được viết là 1s
1 , nếu chỉ có một điện tử trong quỹ đạo s. Nhưng nếu có một cặp electron, nó có thể được viết bằng 1s 2 . Sau đó, hai điện tử trong quỹ đạo của quỹ đạo chuyển sang hướng đối diện vì sự đẩy lùi xảy ra do cùng một điện tích của hai điện tử. Khi có một electron không ghép, nó được gọi là paramagnetic. Đó là bởi vì nó có thể thu hút bởi một nam châm. Nhưng nếu quỹ đạo được lấp đầy và một cặp electron có mặt, các điện tử không thể bị thu hút bởi một nam châm; điều này được gọi là diamagnetic.
Vòng 2 của quỹ đạo lớn hơn quỹ đạo 1s. Do đó, bán kính của nó lớn hơn quỹ đạo của 1. Đây là vệ tinh tiếp theo của hốc sau khi có quỹ đạo 1 giây. Năng lượng của nó cao hơn 1s quỹ đạo nhưng thấp hơn orbitals khác trong một nguyên tử. 2 quỹ đạo cũng có thể được lấp đầy chỉ với một hoặc hai điện tử. Nhưng quỹ đạo của quỹ đạo chỉ chứa electron chỉ sau khi hoàn thành quỹ đạo 1s.Nguyên lý này được gọi là nguyên lý Aufbau, chỉ ra thứ tự electron đưa vào các quỹ đạo phụ.
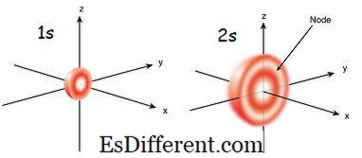
Sự khác nhau giữa Orbital 1s và 2s là gì?
- diff Article Middle before Table ->
1s vs 2s Orbital
1s quỹ đạo là quỹ đạo gần nhất với hạt nhân. |
|
| quỹ đạo 2 giây là quỹ đạo gần nhất thứ hai đến hạt nhân. | Cấp năng lượng |
| Năng lượng của quỹ đạo 1s cao hơn quỹ đạo của 2 giây. | |
| 2 giây có năng lượng tương đối thấp. | Radius orbital |
| Bán kính của quỹ đạo 1s nhỏ hơn. | |
| Bán kính của quỹ đạo 2s tương đối lớn. | Kích thước của orbital |
| quỹ đạo 1s có hình cầu nhỏ nhất. | |
| quỹ đạo 2s lớn hơn quỹ đạo 1s. | Electron Filling |
| Các electron lần đầu tiên được lấp đầy trong quỹ đạo 1s. | |
| quỹ đạo của quỹ đạo chỉ được hoàn thành sau khi hoàn thành các điện tử trong quỹ đạo của quỹ đạo. | Tóm tắt - 1s vs 2s Orbital |
Một nguyên tử là một cấu trúc 3D chứa một hạt nhân ở trung tâm bao quanh bởi orbitals có hình dạng khác nhau có mức năng lượng khác nhau. Các orbitals này lại được chia thành các phân tử phụ theo sự khác biệt nhỏ về năng lượng. Electron, một hạt hạ nguyên tử của một nguyên tử nằm trong các mức năng lượng này. 1s và 2s gần nhất với hạt nhân. Sự khác biệt chính giữa các quỹ đạo 1s và 2s là sự khác biệt về mức năng lượng của chúng, nghĩa là, quỹ đạo 2s là mức năng lượng cao hơn quỹ đạo 1s.
Tài liệu tham khảo:
1. Libretexts. "Nguyên tử Orbitals. "Hóa học LibreTexts. Libretexts, 03 tháng 11 năm 2015. Web. 26 Tháng 5 năm 2017.
2. Nguyên tử, electron và orbital. N. p., n. d. Web. 26 Tháng 5 năm 2017.
Hình ảnh Courtesy:
1. "S orbitals" (cắt xén) Bằng CK-12 Foundation - Tệp: High School Chemistry. pdf, trang 265 (CC BY-SA 3. 0) thông qua Commons Wikimedia


