Sự khác biệt giữa áp suất và áp suất cục bộ Sự khác nhau giữa
Áp suất và áp suất hơi thường được sử dụng các thuật ngữ khoa học liên quan đến lượng áp suất do các thành phần của hệ thống tạo ra, nhưng danh tính của chúng có thể gây nhầm lẫn cho người khác. Có một sự phân biệt rõ ràng giữa các điều khoản này bao gồm cả tác động của họ và nhận dạng. Bài viết này sẽ giải thích thêm về sự khác biệt giữa các thuật ngữ này. Nó cũng sẽ bao gồm một số ví dụ để làm rõ các ứng dụng của nó.
Hãy bắt đầu bằng cách nhấn mạnh khái niệm áp suất trước khi chúng ta có thể tìm hiểu sự phân biệt giữa áp suất hơi và áp suất từng phần. Áp suất được xác định khoa học là lực được áp dụng trên một đơn vị diện tích trên một đối tượng hoặc một chất. Nó cũng có thể được định nghĩa là lực được áp dụng bởi các hạt va chạm vào nhau và nó thường được đo bằng Pascal. Trong trường hợp va chạm hạt, phương trình khí và lý thuyết động học của khí được sử dụng để tính toán áp suất.
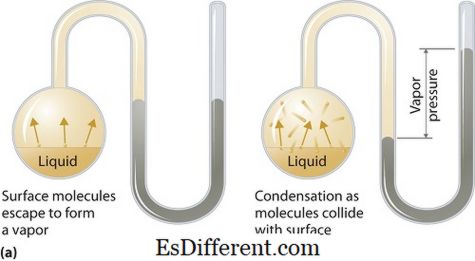
Áp suất hơi là gì?
Áp suất hơi có thể áp dụng cho các pha lỏng hoặc pha rắn. Đây là áp suất do hơi trong trạng thái lỏng hoặc rắn ở nhiệt độ nhất định trong một hệ thống khép kín khi cả hai hơi và chất lỏng tiếp xúc. Áp suất này phát sinh do sự bốc hơi, được kích hoạt bởi nhiệt tăng lên trên chất rắn hoặc chất lỏng. Do đó, nhiệt độ được sử dụng như là thước đo sự bốc hơi và tỷ lệ thuận với áp suất hơi. Điều này có nghĩa, nhiệt độ càng cao thì áp suất hơi càng cao.
Trong quá trình bốc hơi, các phân tử không khí thoát ra như là kết quả của năng lượng động học cao hơn tới không khí trong một hệ thống kín. Sau đó, khi ở trạng thái cân bằng, áp suất hơi phát sinh giữa hơi và dạng chất rắn cô đặc (rắn). Trong các dung dịch, nơi các lực liên phân tử yếu, áp suất hơi có khuynh hướng tăng và ngược lại trong các dung dịch có lực mạnh liên phân tử mạnh hơn, áp suất hơi ít hơn.Áp suất hơi cũng có thể xảy ra trong các hỗn hợp lý tưởng như được giải thích bởi Luật của Raoult. Nó chỉ ra rằng áp suất hơi một phần của một thành phần đặc biệt trong một hỗn hợp lỏng hoặc rắn bằng với áp suất hơi của thành phần đó nhân với phân số mol của nó trong hỗn hợp đó tại một nhiệt độ nhất định. Ví dụ dưới đây sẽ minh hoạ điều đó.
Ví dụ 1.
Cho hỗn hợp lý tưởng là 0. 5 mol. ethanol và 1,25 mol. methanol với áp suất hơi 30KPa và 52KPa, tương ứng, xác định áp suất hơi từng phần của mỗi thành phần.
Giải pháp:
Tổng số nốt ruồi là 1. 5mol + 0. 5mol = 2. 0mol. Theo Luật Raoult, áp suất hơi một phần bằng áp suất hơi nhân với phân số mol của thành phần đặc biệt đó.Trong trường hợp này, P
methanol = 1 5/2 * 52 = 39KPa và P ethanol = 0. 5/2 * 30 = 7. 5KPa. Khi bạn có áp suất hơi một phần của các thành phần trong hỗn hợp, bạn có thể nhận được tổng lượng hơi áp lực bằng cách thêm chúng với nhau. Về mặt này, 7. 5 + 39 cho 46. Tổng áp suất 5KPa của hỗn hợp các dung dịch ethanol và methanol.
Các yếu tố ảnh hưởng đến áp suất hơi
Nhận dạng phân tử
Như đã đề cập ở trên, các loại lực lượng phân tử xác định lượng áp suất hơi được sử dụng. Nếu lực mạnh hơn thì áp suất hơi ít hơn, và nếu yếu hơn thì áp suất hơi tăng lên. Do đó, thành phần của chất lỏng hoặc chất rắn sẽ ảnh hưởng đến áp suất hơi.
Nhiệt độ
Nhiệt độ cao hơn dẫn đến áp suất hơi cao hơn bởi vì nó kích hoạt động năng nhiều hơn để phá vỡ các lực lượng phân tử để các phân tử có thể thoát ra bề mặt chất lỏng một cách nhanh chóng. Khi áp suất hơi (áp suất hơi bão hòa) tương đương với áp suất bên ngoài (áp suất không khí), chất lỏng sẽ bắt đầu sôi. Nhiệt độ thấp sẽ dẫn đến áp suất hơi thấp và sẽ mất thời gian để nước đun sôi.
Luật áp suất từng phần của Dalton

Áp lực từng phần là gì?
Ý tưởng áp lực từng phần lần đầu tiên được đề xuất bởi nhà khoa học nổi tiếng John Dalton. Nó đã sinh ra Luật Áp lực riêng của nó mà nói rằng tổng áp lực gây ra bởi một hỗn hợp khí lý tưởng bằng với tổng của áp suất từng phần của từng khí. Nói một container đặc biệt chứa đầy khí Hydrogen, Nitơ và Oxy, áp suất tổng, P
TỔNG, sẽ bằng với tổng lượng oxy, nitơ và hydro. Áp suất từng phần của bất kỳ khí nào trong hỗn hợp đó được tính bằng cách nhân tổng số áp suất bằng phần mol của từng loại khí. Tóm lại, áp lực từng phần là áp lực gây ra bởi một khí cụ thể trong hỗn hợp như thể nó đang hoạt động một mình trong hệ thống. Do đó, bạn bỏ qua các khí khác khi xác định áp lực từng phần của một khí riêng lẻ. Lý thuyết này có thể được xác minh bằng cách tiêm, ví dụ, 0. 6atm của O
2 trong bình chứa 10. 0 L tại 230K và sau đó tiêm chích 0.4atm N 2 trong cùng một thùng chứa có cùng kích thước ở cùng một nhiệt độ và cuối cùng kết hợp khí để đo áp suất tổng; nó sẽ là tổng của hai loại khí. Điều này giải thích rõ ràng áp lực từng phần của một loại khí riêng lẻ trong hỗn hợp khí không phản ứng. Tính áp suất từng phần
Để tính áp lực riêng từng phần là một làn gió tuyệt đối vì luật của Dalton [1] quy định về điều đó. Nó sẽ phụ thuộc vào thông tin điển hình được cung cấp. Nếu, ví dụ, tổng áp suất được cho cho hỗn hợp khí A và B cũng như áp suất khí A, áp suất riêng của B có thể được tính bằng cách sử dụng P
TỔNG = P A + P B . Phần còn lại là các thao tác đại số. Nhưng trong trường hợp chỉ tổng cộng áp lực của hỗn hợp, bạn có thể sử dụng phân số mol của khí B để xác định áp lực từng phần.Phân số mol, được biểu hiện bởi X, có thể được tìm thấy bằng cách chia các nốt ruồi của khí B với tổng số mol của hỗn hợp khí. Sau đó để tìm áp suất riêng, bạn sẽ nhân phân phân mol, X, bằng tổng áp suất. Ví dụ dưới đây giải thích điều đó. Ví dụ 2.
Một hỗn hợp của Nitơ và oxy, với 2,5 mola và 1,85 moles tương ứng, được tiêm trong một bình chứa 20 o 0 với áp suất tổng cộng là 4atm; tính áp suất riêng của khí oxy.
Giải pháp:
Tổng số nốt ruồi trong hỗn hợp là 2,5 + 1,85 = 4,35 mola. Vì vậy, phân số mol của Oxy, X
o , sẽ là 1. 85 moles / 4. 35 mol = 0. 425 mol. Áp suất riêng của oxy sẽ là 0. 425 * 4atm = 1. 7atm. Áp suất riêng của khí còn lại có thể được tính theo phương pháp tương tự hoặc có thể được tính toán bằng cách sử dụng khí Oxi và tổng áp suất như được quy định trong luật áp suất riêng của Dalton rằng tổng áp lực của khí không phản ứng bằng với tổng của áp lực từng phần. Sự khác biệt giữa áp suất hơi và áp suất riêng
Từ các giải thích trên đây, rõ ràng áp suất hơi và áp suất từng phần là hai áp suất riêng biệt. Áp suất hơi áp dụng cho các pha lỏng và pha rắn trong khi áp suất riêng áp dụng cho pha khí. Áp suất hơi được thực hiện trong pha chuyển tiếp sau khi nhiệt đủ đã được đưa vào dung dịch dẫn đến các phân tử của nó thoát ra trong một hệ thống khép kín.
Sự khác biệt chính giữa áp suất cục bộ và áp suất hơi là áp lực từng phần là áp lực gây ra bởi một khí riêng lẻ trong một hỗn hợp như thể nó đơn độc trong hệ thống đó, trong khi áp suất hơi là áp suất do hơi trong trạng thái cân bằng nhiệt động lực học với trạng thái ngưng tụ của chất lỏng hoặc chất rắn. Bảng dưới đây cho phép so sánh ngắn gọn các áp lực này.
Áp suất hơi
| Áp suất riêng | Nó được tạo ra bởi hơi nước hoặc lỏng trên pha rắn trong trạng thái cân bằng |
| Nó được gây ra bởi các khí riêng lẻ trong một hỗn hợp khí không phản ứng 999 Giải thích bởi các phản ứng của Raoult Luật | Giải thích bằng Luật của Dalton |
| Áp dụng cho các giai đoạn rắn và lỏng | Chỉ áp dụng trong các pha khí |
| Không phụ thuộc diện tích bề mặt hoặc thể tích của hệ thống | Tính bằng các khí trong cùng thể tích |
| Tính bằng cách sử dụng phân số mol của chất tan | Tính bằng cách sử dụng phân số mol của khí |
| Wrap Up! | Áp suất hơi và áp suất từng phần là hai thuật ngữ khoa học quan trọng được sử dụng để xác định các ảnh hưởng của các lực được áp dụng bởi hơi và khí tương ứng trong hệ thống khép kín tại các nhiệt độ cụ thể. Sự khác biệt chính của chúng là khu vực ứng dụng với áp suất hơi áp dụng cho các pha lỏng hoặc pha rắn, trong khi áp suất riêng lẻ được áp dụng cho từng loại khí trong hỗn hợp các khí lý tưởng trong một thể tích nhất định. |
Áp suất riêng được tính toán một cách dễ dàng bằng cách tuân theo Luật áp lực riêng của Dalton, trong khi áp suất hơi được tính bằng cách áp dụng Luật của Raoult.Trong bất kỳ hỗn hợp nhất định, mỗi thành phần khí áp lực riêng của nó, được gọi là áp lực riêng biệt của các khí khác. Và khi bạn tăng gấp đôi số mol của bất kỳ thành phần nào có nhiệt độ không đổi, bạn sẽ tăng áp suất từng phần. Theo quan hệ Clausius-Clapeyron [2], áp suất hơi tăng khi nhiệt độ tăng.
Với những thông tin nói trên, bạn sẽ có thể phân biệt giữa áp suất hơi và áp suất từng phần. Bạn cũng có thể tính toán chúng bằng các phân số mol và nhân với tổng áp suất. Chúng tôi đã cung cấp cho bạn các ví dụ điển hình để xây dựng về áp dụng các áp lực này.




