Sự khác biệt giữa các ion và các hợp chất Covalent | Ionic vs Covalent Compounds
Sự khác biệt cơ bản - Ionic và Covalent Compound
Có nhiều sự khác biệt giữa các hợp chất ion và covalent nước, độ dẫn điện, điểm nóng chảy và điểm sôi. Lý do chính cho những khác biệt này là sự khác biệt trong mô hình liên kết của chúng. Vì vậy, mô hình liên kết có thể được coi là sự khác biệt chính giữa ion và các hợp chất đồng hóa trị. (Sự khác biệt giữa ion và liên kết Covalent) Khi các liên kết ion được hình thành, điện tử (electron) được tặng bởi một kim loại và các electron được hiến tặng được chấp nhận bởi một kim loại phi kim loại. Chúng tạo thành một liên kết mạnh mẽ do sự thu hút tĩnh điện. Trái phiếu Covalent được hình thành giữa hai phi kim loại. Trong liên kết cộng hóa trị, hai hoặc nhiều nguyên tử chia sẻ các electron để đáp ứng nguyên tắc octet. Nói chung, liên kết ion mạnh hơn các liên kết cộng hoá trị. Điều này dẫn đến sự khác biệt về tính chất vật lý của chúng.
Hợp chất Ionic là gì?
Các liên kết ion được hình thành khi hai nguyên tử có sự khác nhau lớn về giá trị điện giải. Trong quá trình hình thành liên kết, nguyên tử electron ít gây tổn hại electron và các nguyên tử mang điện sẽ thu được các electron đó. Vì vậy, các loài kết quả là các ion tích điện dương và tạo thành một liên kết do sự thu hút mạnh mẽ của tĩnh điện.
Liên kết ion được hình thành giữa kim loại và phi kim loại. Nói chung, kim loại không có nhiều điện hóa trị ở vỏ ngoài cùng; tuy nhiên, phi kim loại có gần tám electron trong vỏ giá trị. Do đó, phi kim loại có khuynh hướng chấp nhận các electron để đáp ứng nguyên tắc octet.
Ví dụ về hợp chất ion là Na + + Cl - NaCl
Natri (kim loại) chỉ có một điện tử hóa trị và Chlorine (phi kim loại) bảy điện hóa trị.

Hợp chất Covalent là gì?
Các hợp chất Covalent được hình thành bằng cách chia sẻ các electron giữa hai hoặc nhiều nguyên tử để đáp ứng "luật octet". Loại liên kết này thường được tìm thấy trong các hợp chất phi kim loại, các nguyên tử của cùng một hợp chất hoặc các yếu tố lân cận trong bảng tuần hoàn. Hai nguyên tử có giá trị gần như cùng cực điện tử không trao đổi (hiến / nhận) điện tử từ vỏ giá trị của chúng. Thay vào đó, chúng chia sẻ các electron để đạt được cấu hình octet.
Ví dụ về các hợp chất đồng trị thức là Methane (CH 4 ), Carbon monoxide (CO), Iodine monobromide (IBr)
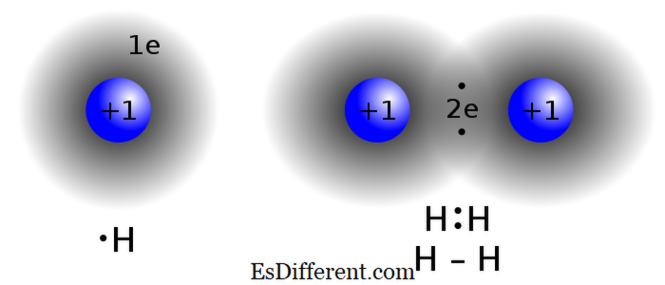
Sự liên kết Covalent
Sự khác nhau giữa Ionic và Covalent Hợp chất?
Định nghĩa các hợp chất ion và các hợp chất mãnh liệt
Hợp chất ion: Hợp chất ion là một hợp chất hóa học của cation và anion được giữ lại với nhau bằng các liên kết ion trong một cấu trúc mạng tinh thể. Hợp chất Covalent:
Hợp chất Covalent là một liên kết hóa học được hình thành bằng việc chia sẻ một hay nhiều điện tử, đặc biệt là các cặp electron, giữa các nguyên tử. Tính chất vật lý
Các thành phần ion:
Tất cả các hợp chất ion tồn tại dưới dạng chất rắn ở nhiệt độ phòng.
Các hợp chất ion có cấu trúc tinh thể ổn định. Do đó, chúng có điểm nóng chảy và điểm sôi cao hơn. Các lực hút giữa các ion dương và âm rất mạnh.
- khác
Hàm lượng ion
Sự xuất hiện| Điểm nóng chảy | NaCl - Natri clorua | Chất rắn tinh thể trắng |
| 801 ° C | KCl - Kali clorua | Tinh thể thủy tinh trắng hoặc không màu |
| 770 ° C | MgCl | 2 |
| - Magiê clorua Các tinh thể kết tinh trắng hoặc không màu 1412 ° C Các hợp chất Covalent: Các hợp chất Covalent tồn tại trong cả ba dạng; như rắn, chất lỏng và khí ở nhiệt độ phòng. | Các điểm nóng chảy và sôi của chúng tương đối thấp so với các hợp chất ion. | Hợp chất Covalent |
Sự xuất hiện
Điểm nóng chảy
HCl-Hydro Chlorua
| Một loại khí không màu | -114. 2 0C | CH |
| 4 | -Methane | Khí không màu |
| -182 ° C CCl 4 | - Carbon tetrachloride | Chất lỏng không màu < -23 ° C |
| Độ dẫn điện Các hợp chất ion: Các hợp chất ion rắn không có các electron tự do; do đó, chúng không dẫn điện ở dạng rắn. Tuy nhiên, khi các hợp chất ion tan trong nước, chúng tạo ra một dung dịch dẫn điện. Nói cách khác, các dung dịch nước của các hợp chất ion là chất dẫn điện tốt. | Các hợp chất Covalent: | Các hợp chất đồng hóa trị thuần hay các dạng hòa tan trong nước không dẫn điện. Do đó, các hợp chất đồng hóa trị liệu dẫn điện kém trong tất cả các giai đoạn. |
Độ hòa tan
Các hợp chất ion: Hầu hết các hợp chất ion hòa tan trong nước, nhưng chúng không hòa tan trong dung môi không cực.
Các hợp chất Covalent: Hầu hết các hợp chất đồng hoá trị liệu đều hòa tan trong dung môi không cực, nhưng không có trong nước.
Độ cứng
Các hợp chất ion: Chất rắn ion là các hợp chất cứng và giòn.
Các hợp chất Covalent: Nói chung, các hợp chất cộng hóa trị ít mềm hơn chất rắn ion.




