Sự khác biệt giữa Ethanol và Ethanol Acid | Ethanol vs Ethanic Acid
Mặc dù Ethanol và Ethanic acid có cùng tên, sự khác biệt chính có thể được nhận thấy giữa chúng vì chúng là hai hợp chất hữu cơ khác nhau có chứa hai nhóm chức năng khác nhau.
Ethanol là thành viên đơn giản nhất thứ 9 của trong khi axit ethanoic là thành viên đơn giản thứ hai của nhóm axit cacboxylic. Cả hai chúng chỉ chứa hai nguyên tử Carbon ngoài nhóm chức năng có trong phân tử. Khi chúng tôi so sánh các tính chất hóa học của chúng; cả hai đều được sử dụng làm dung môi hữu cơ và có mùi đặc trưng. Ngược lại, acid ethanoic có tính axit hơn ethanol.
Ethanollà gì? Tên thông dụng của ethanol là ethyl alcohol . Nhóm chức năng của nó là một nhóm hydroxyl (-OH nhóm). Tất cả các tính chất hóa học như tính phản ứng, tính axit hoặc tính cơ bản phụ thuộc vào nhóm chức năng. Ethanol có mùi rất nhẹ, và nó là một hợp chất dễ bay hơi. Ethanol rất quan trọng trong các ứng dụng công nghiệp; nó là một dung môi an toàn, một nguồn nhiên liệu, được sử dụng để sản xuất thuốc và mỹ phẩm và nó là thành phần chính trong thức uống có cồn. Ethanol có thể được sản xuất trong nước bằng cách sử dụng chất thải nông nghiệp như ngô, mía hoặc cỏ.

axit là gì? Tên sử dụng phổ biến nhất đối với axit Ethanoic là axit axetic . Đây là chất lỏng không màu có vị chua đặc trưng và mùi cay. Nó có công thức phân tử của CH
3 COOH. Dạng axit ethanoic không bị pha loãng được gọi là "acid acetic băng" và khoảng 3-9% lượng axit theo thể tích được sử dụng để làm giấm. Ethanic acid được coi là một axit yếu; nhưng nó có tính ăn mòn và có khả năng tấn công da.
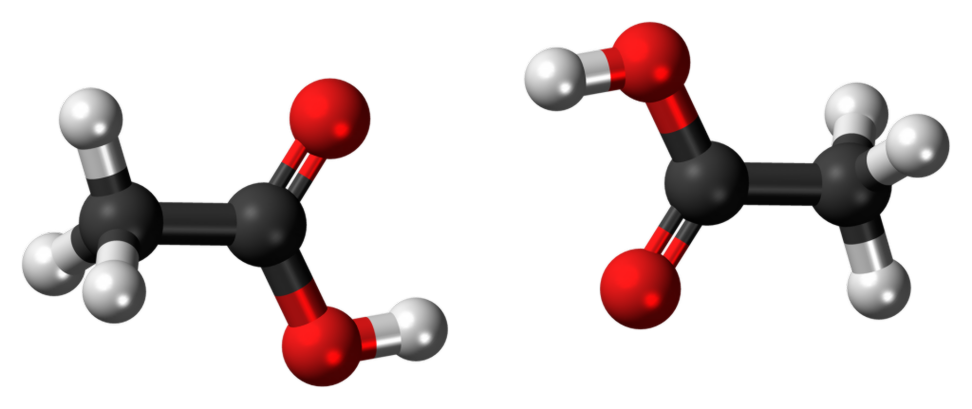
Ethanol:
Hydroxyl nhóm (-OH nhóm) là nhóm chức năng trong ethanol. Đó là đặc tính của rượu. Tất cả các cồn có ít nhất một nhóm -OH trong cấu trúc của chúng.
Ethanoic acid:
Nhóm chức năng trong axit ethanoic là nhóm -COOH. Nó là phổ biến đối với tất cả các axit cacboxylic. Đặc tính:
Ethanol: Ethanol là một loại cồn đơn có mùi ngọt ngào sôi ở 78,5 ° C. Đây là hydrocacbon duy nhất tan trong nước theo mọi tỷ lệ.Ethanol phản ứng với KMnO4 kiềm để tạo ra axit ethanoic trong khi acid ethanoic không phản ứng với KMnO4 kiềm.
Ethanic acid:
Đây là một acid monoprotic yếu trong dung dịch nước (pKa = 4, 76). Axit axetic lỏng là một dung môi phân cực như nước. Nó giải thể cả hai chất lỏng phân cực như đường và muối, và các chất lỏng không thuộc phân cực như dầu và các nguyên tố như lưu huỳnh và iốt. Dễ dàng kết hợp hoàn toàn với chloroform nước, và hexane. Acetic acid có mùi cay mạnh. Sử dụng:
Ethanol: Ethanol có trong đồ uống có cồn và cũng được sử dụng làm nhiên liệu sinh học cho ô tô. Đây là một dung môi tốt có thể hòa tan nhiều dung dịch hữu cơ không hòa tan trong nước. Ethanol được sử dụng để sản xuất nhiều loại nước hoa, mỹ phẩm, và vecni trong ngành sơn.
Ethanol làm nhiên liệu:
CH 3
CH
2 OH + 3O> 2 O Axit Ethanoic: Acetic acid được sử dụng làm chất phản ứng hóa học để sản xuất các hóa chất khác. Nó được sử dụng với số lượng lớn hơn để tạo ra monomer vinyl axetat; vinyl axetat có thể được polyme hóa để sản xuất polyvinyl clorua hoặc các polyme khác. Ngoài ra, axit axetic được sử dụng để sản xuất este được sử dụng trong các loại mực, tranh vẽ và chất phủ. Acetic anhydrit là một hợp chất hóa học quan trọng có thể được tổng hợp bằng cách ngưng tụ hai phân tử axit axetic. Một lượng nhỏ acid ethanoic được sử dụng để sản xuất giấm gia đình. Tính axit: Ethanol: Ethanol không phản ứng với Natri bicarbonate (NaHCO₃) cũng như không làm thay đổi màu sắc của giấy màu xanh lơ. Do đó, nó ít axit hơn acid ethanoic. Axit Ethanoic: Ethanoic acid là một axit yếu phản ứng với Natri bicarbonate (NaHCO₃) làm giảm khí CO 2. Ngoài ra, nó biến chì màu xanh thành màu đỏ. Hình ảnh được phép của "Ethanol-3D-balls". (Public Domain) thông qua Wikimedia Commons Logo Wikimedia Commons có thêm thể loại hình ảnh và tài liệu về: Acetic acid dimer 3D ball. (CC0) thông qua Wikimedia Commons


