Sự khác biệt giữa công thức cân bằng và công thức ion hữu cơ | Phương trình cân bằng so với công thức ion trực tuyến
Sự khác biệt chính - Công thức cân bằng so với công thức ion trực tuyến
Tất cả các phản ứng hóa học có thể được viết như một phương trình. Các thành phần của phương trình này bao gồm các chất phản ứng với các trạng thái vật lý của chúng, một mũi tên để chỉ đường phản ứng và các sản phẩm phản ứng với các trạng thái thể chất của chúng. Nếu có bất kỳ điều kiện đặc biệt được sử dụng, chúng cũng được viết ngắn gọn về mũi tên. Nếu phản ứng ở trạng thái cân bằng, hai mũi tên half được sử dụng theo hướng ngược nhau. Một phương trình hóa học có thể được viết theo hai cách: như phương trình cân bằng hoặc như một phương trình ion ion. Sự khác nhau chủ yếu giữa phương trình cân bằng và phương trình ion là phương trình cân bằng cho thấy tất cả các phản ứng xảy ra trong một hệ thống với nhau trong khi phương trình ion trực tiếp chỉ cho thấy phản ứng mạng xảy ra sau khi hoàn thành điều đó phản ứng.
NỘI DUNG
1. Tổng quan và Chênh lệch khác nhau
2. Phương trình Balanced là gì?
3. Phương trình ion Ion là gì
4. So sánh từng bên - Công thức cân bằng so với công thức ion trực tuyến
5. Tóm tắt
Phương trình cân bằng là gì?
Các phản ứng hóa học rất quan trọng trong việc hiểu được hành vi của một hệ thống cụ thể. Bằng cách viết phương trình chính xác cho phản ứng, người ta có thể có được một ý tưởng về sự thay đổi của các loài khác nhau trong hệ thống đó. Đối với các phản ứng đơn giản như hòa tan NaCl trong nước, phương trình có thể được viết một cách dễ dàng bằng cách dự đoán các sản phẩm có thể có của phản ứng đó. Nhưng đối với các phản ứng phức tạp khác, có thể phải tiến hành các thử nghiệm khác để tìm ra sản phẩm của hệ thống cụ thể đó. Nhưng hầu hết thời gian, phương trình bằng văn bản rất có thể sẽ không cân bằng, làm cho nó khó khăn để giải thích hành vi hóa học của hệ thống đó. Do đó, các phương trình cân bằng cũng phải cân bằng. Phương trình cân bằng bao gồm tất cả các chất phản ứng và các sản phẩm của hệ thống đó. Phương trình được viết bằng cách xem xét hợp chất phản ứng như một phân tử. Ví dụ, phương trình cân bằng giữa KI và PbNO 3 (nếu phản ứng trong nước) sẽ là;

3 và KI nên là 1: 2 khi thêm các thành phần vào hệ thống. Phương trình Ionic Net là gì?
Phương trình ion ion cho thấy chỉ có phản ứng tổng thể xảy ra trong hệ thống. Nó bao gồm các loài ion và các sản phẩm hình thành. Nhưng nó không chỉ ra tất cả các phản ứng đã xảy ra trong một hệ thống cụ thể. Ví dụ, nếu có một phản ứng giữa hai phân tử sử dụng nước làm môi trường, các hợp chất này có thể đã hòa tan trong nước và được tách thành ion. Một số ion này có thể có liên quan đến phản ứng này nhưng một số có thể không. Sau đó, phương trình ion ion bao gồm các ion có tham gia phản ứng mạng. Các ion khác, được gọi là ion quang phổ, được loại bỏ khỏi phương trình để có được phương trình ion ion. Ví dụ, nếu KI và PbNO
3 phản ứng trong nước, phản ứng ion ròng sẽ là;
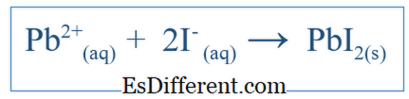
+ ion và NO3 - , nhưng các ion này sẽ chỉ hòa tan và không tham gia phản ứng chính; do đó chúng không được đưa vào phản ứng ion ròng. Sự khác biệt giữa phương trình cân bằng và công thức ion hữu hình là gì?
- khác
Công thức cân bằng so với công thức ion trực tuyến
Tất cả các thành phần đã được sử dụng được viết như các chất phản ứng trong phương trình cân bằng. |
|
| Các phản ứng chỉ liên quan đến phản ứng ròng sẽ được viết bằng phản ứng ion ròng. | Sản phẩm |
| Tất cả các thành phần ở cuối phản ứng được bao gồm trong một phương trình cân bằng. | |
| Trong phương trình ion đơn, chỉ có sản phẩm cuối cùng được ghi. | Chi tiết Với |
| Phương trình cân bằng sẽ cho biết chi tiết về tất cả các loài trong hệ thống. | |
| Phương trình ion tịnh cho biết chi tiết về các loài đã tham gia vào phản ứng | Khi các hợp chất ion nhất định được thêm vào nước, chúng sẽ vỡ ra và hình thành các ion bị tan trong nước. Điều này tạo ra anions và cation. Để cho thấy các loài được sản xuất sau khi hoàn thành phản ứng và hướng phản ứng, có thể viết phương trình hóa học. Phương trình này có thể cân bằng số lượng các nguyên tử của mỗi loài nằm ở hai bên mũi tên; đôi khi, thậm chí cả trách nhiệm của những loài này cũng cần được xem xét. Điều này cho thấy một phương trình hóa học cân bằng cho hệ thống cụ thể đó. Tuy nhiên, phương trình ion đơn thuần chỉ bao gồm các loài bị phản ứng. Như đã đề cập ở trên, sự khác nhau chủ yếu giữa phương trình cân bằng và phương trình ion trung là phương trình cân bằng cho thấy tất cả các phản ứng trong một hệ thống, trong khi phương trình ion thuần chỉ cho thấy phản ứng mạng xảy ra khi hoàn thành phản ứng cụ thể. |
Tài liệu tham khảo:
1. Chang, R., 2010. Hóa học. 10th ed. NewYork: McGraw-Hill.
2. Phản ứng hoá học. (n. d.). Truy lục ngày 26 tháng 5 năm 2017, từ // www. ric. edu / giảng viên / ptiskus / reactions /
3. Hoàn thành công thức ion và ion. (n. d.). Truy lục ngày 26 tháng 5 năm 2017, từ // www. khanacademy. org / khoa học / hóa học / phản ứng hóa học-stoichiome / loại phản ứng hóa học / a / hoàn thiện ion-và-net-ion phương trình.